Lista sobre as funções orgânicas! Bons estudos!
quinta-feira, 28 de fevereiro de 2013
Lista de exercícios 2 - 3º ano do Ensino Médio
Aula 2 _ 1º ano
Olá! Estou postando a aula 2 em slide! Baixem para estudar e fazer a lista de exercícios!
http://rapidshare.com/files/3960533409/aula2.pptx
http://rapidshare.com/files/3960533409/aula2.pptx
Primeira atividade online de Química
Após terem lido os posts Substância Pura e Água Potável x Água Pura vocês já possuem uma base para discutir sobre a pergunta abaixo. Porém não se limitem a estas informações. Sejam mais curiosos. Procurem em outros sites para responder. Esta atividade valerá nota, então caprichem!!! A resposta deverá ser colocada nos COMENTÁRIOS até 08/03/13.
Pergunta:
A água destilada é uma água pura, ou seja, só possui moléculas de água. Ela é considerada uma água própria para o consumo humano? Justifique.
segunda-feira, 25 de fevereiro de 2013
Água Potável x Água Pura
Antes de qualquer coisa, observem bem este copo de água. Suponhamos que eu o peguei de uma bica perto da minha casa. Se eu perguntasse a vocês se este copo d'agua representa uma substância pura, usando os conhecimentos do post Substância Pura, o que responderiam? Podem colocar as respostas nos comentários, ou então me falar na sala de aula, rsrsrsrs.
.....
Bom, como vimos para a água ser uma substância pura ela deve ter apenas moléculas de água (H2O). Mas na água potável não temos apenas moléculas de água, temos também sais minerais entre outras substâncias. Portanto, a água que foi extraída diretamente de uma fonte natural, não é considerada uma água pura para a Química e sim, uma mistura homogênea. Mas o que é uma mistura homogênea? É uma mistura que ao olhar não conseguimos identificar se ali encontra-se uma única substância ou mais. Exemplos: água + álcool, ar atmosférico (mistura de gás oxigênio, gás nitrogênio, etc).
Então, após lerem isso tudo, vocês vão perguntar: Existe água pura na natureza?
A resposta é NÃO! A água quimicamente pura, no sentido rigoroso do termo, constituída exclusivamente de hidrogênio e oxigênio, não existe na natureza, pois, sendo a água um ótimo solvente, nunca é encontrada em estado de absoluta pureza.
A presença de sais minerais na água é essencial à vida orgânica. A expressão água pura é vulgarmente usada como sinônimo de água própria para uso domésticos.
E onde podemos encontrar a água pura?
A água pura, também chamada de água destilada, é obtida por meio de aparelhos próprios em laboratórios. Lá retiram todas as substâncias presentes na água e a deixam apenas com moléculas de água. Mas você também pode obter água pura com aparelhos caseiros.
Material
Chaleira
Garrafa com água fria
Luvas (ou pano)
Recipiente para coleta
Procedimento
1. Coloque água em uma chaleira e deixe ferver até começar a expelir vapores;
2. Segure a garrafa com água fria e a posicione de forma que os vapores expelidos pela chaleira venham de encontro ao fundo da garrafa. Contudo, use luvas para essa tarefa, pois há riscos de queimaduras;
3. Coloque o recipiente coletor embaixo da garrafa para a água que cair fique acumulada em seu interior;
4. A água que respingar da garrafa durante este processo estará 100% pura, ou seja, você obteve água destilada.
Para que água conserve suas propriedades, cubra o recipiente de forma que não tenha contato com o ambiente.
Chaleira
Garrafa com água fria
Luvas (ou pano)
Recipiente para coleta
Procedimento
1. Coloque água em uma chaleira e deixe ferver até começar a expelir vapores;
2. Segure a garrafa com água fria e a posicione de forma que os vapores expelidos pela chaleira venham de encontro ao fundo da garrafa. Contudo, use luvas para essa tarefa, pois há riscos de queimaduras;
3. Coloque o recipiente coletor embaixo da garrafa para a água que cair fique acumulada em seu interior;
4. A água que respingar da garrafa durante este processo estará 100% pura, ou seja, você obteve água destilada.
Para que água conserve suas propriedades, cubra o recipiente de forma que não tenha contato com o ambiente.
Substância Pura
Substância pura é um sistema que possui apenas moléculas de uma mesma substância. Sendo assim, apresentam propriedades físicas e químicas constantes como: ponto de fusão, ponto de ebulição, composição, densidade, cor.
A substância pura pode ser simples ou composta. Ela será simples quando suas moléculas forem formadas por átomos iguais. E será composta quando suas moléculas forem formadas por átomos diferentes.
Substância pura simples: moléculas com átomos iguais
Substância pura composta: moléculas com átomos diferentes
O que vocês principalmente devem guardar deste gráfico é que os patamares de fusão e ebulição permanecem constantes durante a mudança de fase.
sexta-feira, 22 de fevereiro de 2013
Primeira aula do 1º ano no laboratório
A turma estava muito animada . Continuem com este entusiasmo! Fico vendo estas fotos e pensando.... Já dei aula para eles na 4ª série!!!! Espero que aproveitem bastante todas as inovações que o IESA este ano oferece: sala com quadro digital (estou muito ansiosa para estrear, rsrsrsrs), laboratório de informática, os equipamentos para experimentos de física, etc....
quarta-feira, 20 de fevereiro de 2013
1º ano/ Lista de exercícios 1
"Vamos, vamos estudar
E cumprir nosso dever
A virtude praticar
E aumentar nosso saber"
Pessoal, é hora de pegar firme nos estudos! É importante encara os conteúdos seriamente. Neste tópico segue o link da aula 1 em PowerPoint e também a primeira lista de exercícios. Todas as semanas teremos uma lista e valem nota. Façam os exercícios e tirem as dúvidas na sala de aula.
Link da aula 1:
http://rapidshare.com/files/3667089504/aula1.pptxLink da Lista de exercícios 1:
http://rapidshare.com/files/1741278442/lista1.docx
segunda-feira, 4 de fevereiro de 2013
Diamante e grafite

Vocês sabiam que tanto o diamante como o grafite são formados pelo mesmo elemento???? Muito legal, né?! Esse elemento é o CARBONO. A diferença entre eles está na forma que os seus átomos estão ligados uns aos outros. Essa diferença nas ligações torna possível termos duas substâncias completamente diferentes, porém formadas pelo mesmo elemento! Vejamos abaixo.
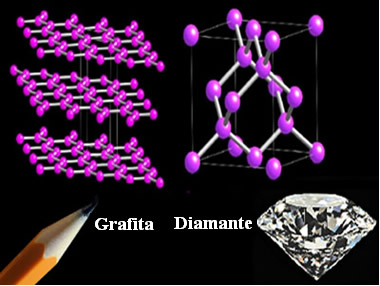
Os diamantes são formados na natureza pela grande quantidade de pressão e calor das profundezas da Terra, geralmente a mais de 100 km de profundidade. Eles ascenderam à superfície através de erupções vulcânicas.
Atualmente há cientistas que estão produzindo diamante em laboratório, mas os gastos são muito grandes e o preço final sai quase o mesmo do diamante natural.
Na química este fenômeno que ocorre entre o grafite e o diamante é chamado de alotropia. Alotropia é a propriedade que alguns elementos químicos têm de formar uma ou mais substâncias simples diferentes.
Isso não ocorre apenas com o carbono. Acontece também com o oxigênio, fósforo e o enxofre.
sábado, 2 de fevereiro de 2013
Aula 1/ 1º ano IESA
Esta é a nossa primeira aula. É uma introdução aos nossos estudos. Baixem o arquivo. Não é vírus.
http://rapidshare.com/files/3290868294/aula1-introdu%C3%A7%C3%A3o.pptx
Estudem bastante! rsrs
http://rapidshare.com/files/3290868294/aula1-introdu%C3%A7%C3%A3o.pptx
Estudem bastante! rsrs
Iniciando nossos estudos: O que é MATÉRIA?
Algumas pessoas ao escutar a palavra matéria pode logo imaginar ....
hummmm.... matéria?! Deve ser as disciplinas de Química, Física, Matemática,
Português. Mas vamos falar aqui sobre o que é MATÉRIA para a
química.
A definição de matéria é: QUALQUER
COISA QUE OCUPA ESPAÇO E POSSUI MASSA. Ela pode ser líquida, sólida ou gasosa.
A matéria é composta por elementos químicos.
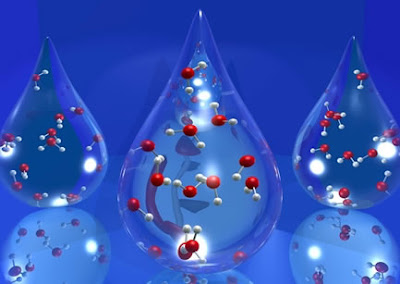
Observem na figura acima como se comportam as moléculas de água
nos três estados físicos. Há uma teoria que se chama cinético-molecular - cinético
tem haver com movimento e molecular das moléculas - que explica esse
comportamento. No estado sólido as moléculas estão muito unidas, ou seja,
possuem muito pouca energia cinética. No estado líquido e gasoso as moléculas
estão arranjadas aleatoriamente, ou seja, não estão confinadas às posições
específicas e podem se mover. As partículas dos gases se movem muito mais do
que as do líquido, dessa forma estão bem distantes uma das outras. Portanto, os
gases possuem muita energia cinética.
Resumo: Características da matéria
Sólido: Nesse estado físico da matéria, as moléculas se encontram muito próximas, sendo assim possuem forma fixa, volume fixo e não sofrem compressão.
Assinar:
Postagens (Atom)
.jpg)